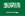1. Disosiasi langsung dan adsorpsi molekul air
Pada situs logam tak jenuh oksida logam atau oksida semikonduktor (seperti Ti4+, Fe3+), molekul air pertama-tama teradsorpsi dalam bentuk molekul, diikuti oleh pemutusan ikatan O-H, menghasilkan gugus hidroksil jembatan atau terminal (M-OH) dan atom hidrogen permukaan. Kekuatan pendorong termodinamika proses ini berasal dari keasaman ion logam Lewis yang kuat, membuat molekul air mudah terdisosiasi. Eksperimen dan perhitungan DFT menunjukkan bahwa permukaan yang ditutupi dengan oksigen rendah cenderung terdisosiasi dan teradsorpsi, sedangkan permukaan yang ditutupi dengan oksigen tinggi cenderung menyerap molekul.
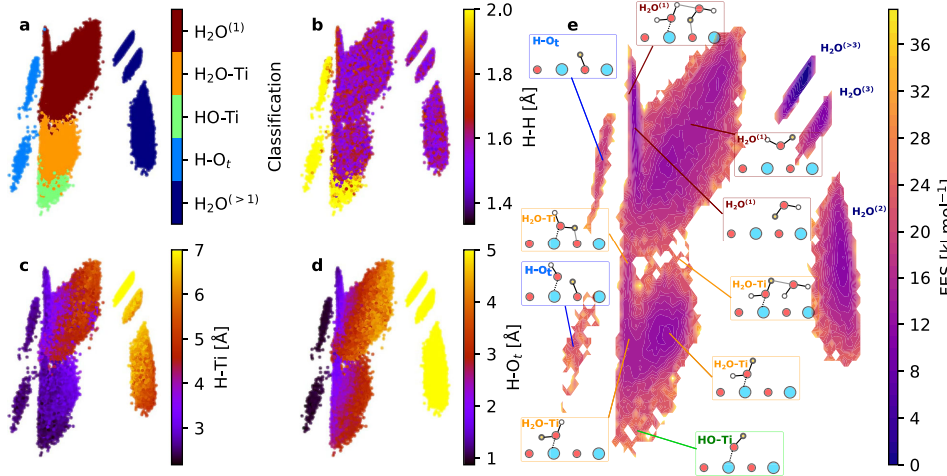
2. Kekosongan oksigen (VO) yang dimediasi oleh pembentukan hidroksil
Kekosongan oksigen di permukaan menyediakan elektron, membuat molekul air yang teradsorpsi lebih rentan terhadap disosiasi. Setelah molekul air teradsorpsi pada kekosongan tersebut, dua gugus hidroksil dihasilkan, salah satunya mengisi kekosongan tersebut dan yang lainnya tergantung pada logam yang berdekatan. Mekanisme ini menjelaskan fenomena peningkatan densitas hidroksil yang signifikan pada kondisi reduksi atau suhu tinggi, dan berkaitan erat dengan perubahan bilangan koordinasi ion logam.
3. Hidrogen atau atom hidrogen meluap
Pada antarmuka logam/oksida, H2 berdisosiasi pada logam membentuk H ⁺/H ⁻, yang kemudian bermigrasi ke permukaan oksida logam melalui luapan hidrogen dan membentuk gugus hidroksil dengan oksigen permukaan. Proses ini diamati secara langsung dalam sistem katalitik seperti oksidasi CO suhu rendah, dan luapan hidrogen secara signifikan meningkatkan laju pembentukan gugus hidroksil permukaan.
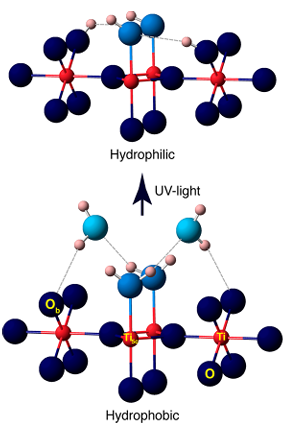
4. Pembentukan hidroksil yang diinduksi fotokatalitik/UV
Sinar UV merangsang semikonduktor seperti TiO2 untuk menghasilkan pasangan lubang elektron, yang menangkap atom oksigen permukaan untuk membentuk O ⁻, dan kemudian bereaksi dengan molekul air atau gugus hidroksil yang teradsorpsi untuk menghasilkan OH ⁻ permukaan, disertai dengan produksi radikal hidroksil (· OH). Eksperimen telah menunjukkan bahwa iradiasi UV menghasilkan kekosongan oksigen tambahan pada permukaan TiO2, yang selanjutnya bereaksi dengan air untuk menghasilkan lebih banyak gugus hidroksil, yang menyebabkan superhidrofilisitas yang diinduksi foto.
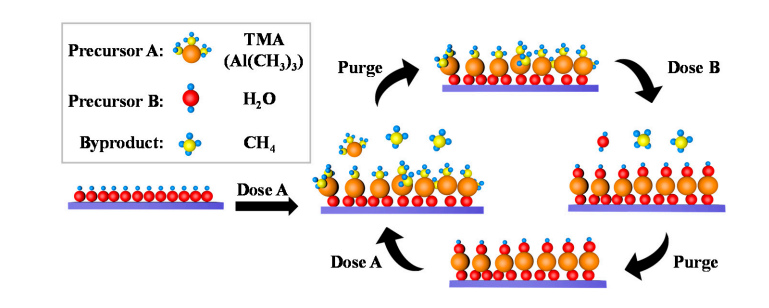
5.Pembentukan gugus hidroksil pada permukaan aluminium oksida
Sejumlah kecil gugus hidroksil secara alami ada pada permukaan aluminium oksida, dan molekul air berdisosiasi dan teradsorpsi pada gugus hidroksil ini, menghasilkan Al-OH baru. Selama pengendapan lapisan atom (ALD), TMA (trimethylaluminum) mengalami pertukaran koordinasi dengan gugus hidroksil permukaan untuk membentuk ikatan Al-O-Al dan melepaskan metana; Selanjutnya, pulsa air bereaksi lagi dengan ikatan Al-O untuk meregenerasi gugus hidroksil permukaan, mencapai regenerasi siklik gugus hidroksil.
6. Rekonstruksi permukaan - Migrasi logam menyebabkan agregasi hidroksil
Pada permukaan kristal alumina atau titanium oksida, ion logam lokal (seperti Al3+) bermigrasi ke kekosongan permukaan di bawah suhu tinggi atau potensi hidrokimia tinggi, membentuk gugus hidroksil tipe Al (OH) 3 atau Ti (OH) 3. Rekonstruksi ini disertai dengan distorsi kisi, yang membuat adsorpsi gugus hidroksil pada molekul air yang berdekatan menjadi lebih baik, sehingga membentuk lapisan dasar hidroksil dengan kepadatan tinggi.
7. Mekanisme hidrolisis gugus hidroksil pada permukaan silikon
Pada ikatan jembatan Si-O-Si, molekul air bergabung dengan ikatan oksigen silikon melalui transfer elektron proton yang sinergis, membentuk gugus Si-OH. Proses ini sangat penting dalam korosi tegangan pada ujung retak dan hidrolisis permukaan kaca, dan peningkatan getaran tarik Si-OH diamati secara langsung dengan spektroskopi inframerah eksperimental.
SAT NANO adalah pemasok bubuk nano dan partikel mikro terbaik di China, kami dapat menawarkan bubuk karbon nanotube, seperti
MWCNT-COOH,
MWCNT-OH, jika Anda memiliki pertanyaan, jangan ragu untuk menghubungi kami di sales03@satnano.com